
试验信息
试验分期:Ⅱ期
药品名称:赛克乳香酸软膏
适应症:非节段型白癫疯患者
患者画像:年龄不超过65岁,面颈部脱色面积≥0.5% BSA、F-VASI≥0.5,全身脱色面积不少于3%且不超过10%BSA,白癜风疾病活动程度评分<4分的非节段型白癜风受试者
在非节段型白癜风受试者中评估赛克乳香酸(CKBA)软膏安全性、有效性的多中心、随机、双盲、平行、溶媒对照、剂量探索Ⅱ期临床试验
主要入选标准
1.临床诊断为非节段型白癜风受试者,面颈部脱色面积≥0.5% BSA、F-VASI≥0.5,全身脱色面积(面颈部和非面颈部)不少于3%且不超过10%BSA;
2.受试者白癜风疾病活动程度评分(VIDA)需满足VIDA<4分;
3.签署知情同意书时,年龄18~65岁之间(包括18岁和65岁),性别不限;
4.受试者同意从筛选访视到最后安全随访期间,不采用方案允许之外的其他白癜风治疗;
主要排除标准
1.受试者面部白癜风区域内毛发完全脱色;
2.临床诊断为节段型白癜风或其他皮肤脱色疾病(如斑状白化病、白色糠疹、麻风病、炎症后色素沉着不足、进行性斑状色素减少症、化学性白皮病和花斑癣)的受试者;
3.受试者既往接受过白癜风脱色治疗(如莫诺苯腙);
4.受试者患有研究者认为会干扰试验药物应用或研究评估的其他皮肤疾病(如,银屑病、脂溢性皮炎等);
5.受试者基线前4周内患有急性细菌、真菌或病毒性皮肤感染(如,单纯疱疹、带状疱疹、水痘);
6.基线前12周内出现严重感染的局部感染(如,蜂窝组织炎、脓肿)或全身性感染(如,肺炎、脓毒症),需静脉抗感染治疗或因感染导致住院;
7.筛选时受试者病史、症状提示患有活动性结核;
8.受试者患有严重活动性自身免疫性疾病;
9.有恶性肿瘤病史的受试者,但以下经充分治疗的非转移性恶性肿瘤除外:不涉及白癜风区域的基底细胞皮肤癌、皮肤鳞状细胞癌或原位宫颈癌。
10.受试者有抑郁症病史,或研究者临床上判断有自杀风险的受试者将被排除;
11.基线前6个月内出现以下心脑血管疾病:受试者曾发生中度至重度充血性心力衰竭(纽约心脏病协会III或IV级)、不稳定心绞痛、心肌梗死、冠状动脉支架植入术、脑血管意外(脑梗塞或脑出血)、深静脉血栓、肺栓塞等,或筛选期控制不佳的高血压(收缩压≥160 mmHg或者舒张压≥100 mmHg,经过复测确认);
12.有重度、进展性或未控制的肝、肾、血液、消化、代谢、内分泌、肺、心血管或神经系统疾病;
13.筛选访视前不能停止或研究期间预期需要使用下述禁用治疗方法/药物:
●筛选前2周内接受了白癜风局部治疗,如,局部糖皮质激素、钙调神经磷酸酶抑制剂、维生素D3衍生物、磷酸二酯酶4 (PDE-4)抑制剂、Janus激酶(JAK)抑制剂
●在筛选前2周内接受了白癜风中药治疗
●筛选前4周内接受了黑色素细胞刺激激素类似物,如,阿法诺肽
●筛选前4周内接受了系统性免疫调节药物,如,口服糖皮质激素、甲氨蝶呤、环孢素、钙调神经磷酸酶抑制剂、Janus激酶(JAK)抑制剂
●筛选前4周内接受了任何其他可能增加皮肤对紫外线/可见光敏感度或影响皮肤色素沉着的全身疗法,例如四环素、补骨脂素
●在筛选前8周内接受了光疗/光化学治疗(包括补骨脂素和长波紫外线(PUVA)准分子激光、准分子光或窄谱中波紫外线(NB⁃UVB))
●筛选前12周或5个半衰期(以较长者为准)使用任何治疗白癜风的生物制剂,或参加过(已随机)任何药物的临床试验
14.基线前12周内接种了活疫苗,或计划在研究期间接种活疫苗 (紧急接种狂犬病疫苗除外);
15.人类免疫缺陷病毒(HIV)、丙型肝炎病毒或梅毒相关实验室检查阳性,乙型肝炎表面抗原(HBsAg)阳性且HBV DNA阳性的受试者;
16.筛选时实验室检测值有临床意义,研究者判断不适宜参加研究,或有以下任意一种特定异常情况:
●天门冬氨酸氨基转移酶(AST)或丙氨酸氨基转移氨酶(ALT)>2倍正常值上限(ULN)
●总胆红素(TBil)>1.5倍正常值上限(吉尔伯特综合征除外,即部分胆红素表明结合胆红素<35%总胆红素)
●CKD-EPI(基于血清肌酐)估算的肾小球滤过率(eGFR) < 60 mL/(min·1.73㎡ )
17.筛选时研究者确定有临床意义的TSH或游离T4异常筛选时或首次给药前基线时心电图QTcF≥450 ms;或存在II度或III度房室传导阻滞或其他有临床意义的心电图异常,研究者判断不适宜参加研究;
18.在筛选前半年内有酗酒或非法药物滥用史;
19.对本试验药物成分或辅料过敏;
20.筛选前30天内有过大创伤或接受过任何外科大手术或者预期研究期间将进行外科大手术;
21.研究者认为会妨碍受试者遵循和完成研究方案、及受试者不适合参与临床研究的任何其它情况。
研究中心
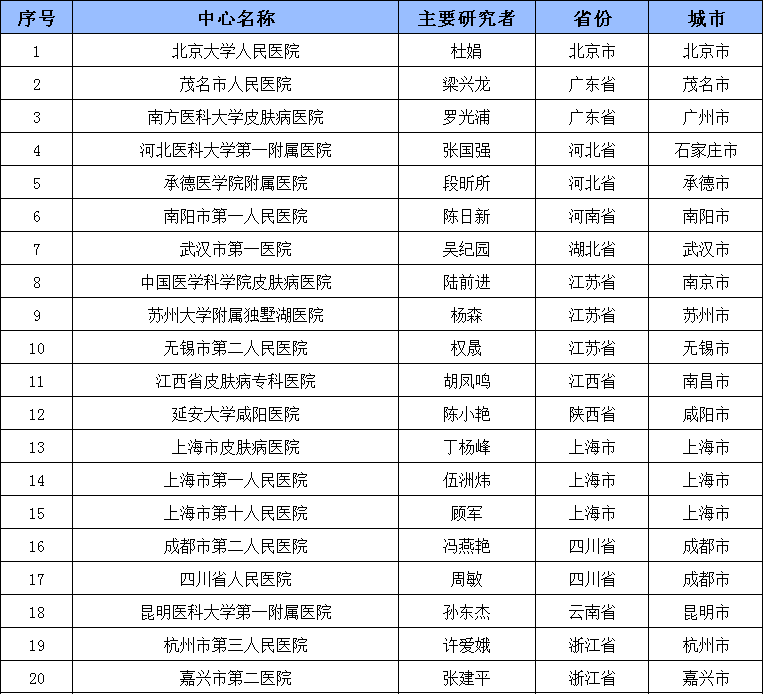
试验信息
试验分期:Ⅱ期
药品名称:赛克乳香酸软膏
适应症:非节段型白癫疯患者
患者画像:年龄不超过65岁,面颈部脱色面积≥0.5% BSA、F-VASI≥0.5,全身脱色面积不少于3%且不超过10%BSA,白癜风疾病活动程度评分<4分的非节段型白癜风受试者
在非节段型白癜风受试者中评估赛克乳香酸(CKBA)软膏安全性、有效性的多中心、随机、双盲、平行、溶媒对照、剂量探索Ⅱ期临床试验
主要入选标准
1.临床诊断为非节段型白癜风受试者,面颈部脱色面积≥0.5% BSA、F-VASI≥0.5,全身脱色面积(面颈部和非面颈部)不少于3%且不超过10%BSA;
2.受试者白癜风疾病活动程度评分(VIDA)需满足VIDA<4分;
3.签署知情同意书时,年龄18~65岁之间(包括18岁和65岁),性别不限;
4.受试者同意从筛选访视到最后安全随访期间,不采用方案允许之外的其他白癜风治疗;
主要排除标准
1.受试者面部白癜风区域内毛发完全脱色;
2.临床诊断为节段型白癜风或其他皮肤脱色疾病(如斑状白化病、白色糠疹、麻风病、炎症后色素沉着不足、进行性斑状色素减少症、化学性白皮病和花斑癣)的受试者;
3.受试者既往接受过白癜风脱色治疗(如莫诺苯腙);
4.受试者患有研究者认为会干扰试验药物应用或研究评估的其他皮肤疾病(如,银屑病、脂溢性皮炎等);
5.受试者基线前4周内患有急性细菌、真菌或病毒性皮肤感染(如,单纯疱疹、带状疱疹、水痘);
6.基线前12周内出现严重感染的局部感染(如,蜂窝组织炎、脓肿)或全身性感染(如,肺炎、脓毒症),需静脉抗感染治疗或因感染导致住院;
7.筛选时受试者病史、症状提示患有活动性结核;
8.受试者患有严重活动性自身免疫性疾病;
9.有恶性肿瘤病史的受试者,但以下经充分治疗的非转移性恶性肿瘤除外:不涉及白癜风区域的基底细胞皮肤癌、皮肤鳞状细胞癌或原位宫颈癌。
10.受试者有抑郁症病史,或研究者临床上判断有自杀风险的受试者将被排除;
11.基线前6个月内出现以下心脑血管疾病:受试者曾发生中度至重度充血性心力衰竭(纽约心脏病协会III或IV级)、不稳定心绞痛、心肌梗死、冠状动脉支架植入术、脑血管意外(脑梗塞或脑出血)、深静脉血栓、肺栓塞等,或筛选期控制不佳的高血压(收缩压≥160 mmHg或者舒张压≥100 mmHg,经过复测确认);
12.有重度、进展性或未控制的肝、肾、血液、消化、代谢、内分泌、肺、心血管或神经系统疾病;
13.筛选访视前不能停止或研究期间预期需要使用下述禁用治疗方法/药物:
●筛选前2周内接受了白癜风局部治疗,如,局部糖皮质激素、钙调神经磷酸酶抑制剂、维生素D3衍生物、磷酸二酯酶4 (PDE-4)抑制剂、Janus激酶(JAK)抑制剂
●在筛选前2周内接受了白癜风中药治疗
●筛选前4周内接受了黑色素细胞刺激激素类似物,如,阿法诺肽
●筛选前4周内接受了系统性免疫调节药物,如,口服糖皮质激素、甲氨蝶呤、环孢素、钙调神经磷酸酶抑制剂、Janus激酶(JAK)抑制剂
●筛选前4周内接受了任何其他可能增加皮肤对紫外线/可见光敏感度或影响皮肤色素沉着的全身疗法,例如四环素、补骨脂素
●在筛选前8周内接受了光疗/光化学治疗(包括补骨脂素和长波紫外线(PUVA)准分子激光、准分子光或窄谱中波紫外线(NB⁃UVB))
●筛选前12周或5个半衰期(以较长者为准)使用任何治疗白癜风的生物制剂,或参加过(已随机)任何药物的临床试验
14.基线前12周内接种了活疫苗,或计划在研究期间接种活疫苗 (紧急接种狂犬病疫苗除外);
15.人类免疫缺陷病毒(HIV)、丙型肝炎病毒或梅毒相关实验室检查阳性,乙型肝炎表面抗原(HBsAg)阳性且HBV DNA阳性的受试者;
16.筛选时实验室检测值有临床意义,研究者判断不适宜参加研究,或有以下任意一种特定异常情况:
●天门冬氨酸氨基转移酶(AST)或丙氨酸氨基转移氨酶(ALT)>2倍正常值上限(ULN)
●总胆红素(TBil)>1.5倍正常值上限(吉尔伯特综合征除外,即部分胆红素表明结合胆红素<35%总胆红素)
●CKD-EPI(基于血清肌酐)估算的肾小球滤过率(eGFR) < 60 mL/(min·1.73㎡ )
17.筛选时研究者确定有临床意义的TSH或游离T4异常筛选时或首次给药前基线时心电图QTcF≥450 ms;或存在II度或III度房室传导阻滞或其他有临床意义的心电图异常,研究者判断不适宜参加研究;
18.在筛选前半年内有酗酒或非法药物滥用史;
19.对本试验药物成分或辅料过敏;
20.筛选前30天内有过大创伤或接受过任何外科大手术或者预期研究期间将进行外科大手术;
21.研究者认为会妨碍受试者遵循和完成研究方案、及受试者不适合参与临床研究的任何其它情况。
研究中心
