
试验信息
试验分期:II期
药品名称:BW-00112 注射液
适应症:重度高甘油三酯血症患者
患者画像:年龄不超过 75 周岁,TG (高油三脂)≥ 500 mg/dL(5.6 mmol/L)且≤ 4000 mg/dL(45 mmol/L)的重度高甘油三酯血症患者
注:边缘升高:甘油三酯水平在 1.7~2.3 mmol/L;升高:血清甘油三酯水平在 2.3~5.6 mmol/L;重度升高:血清甘油三酯水平大于 5.6 mmol/L。
试验专业题目
一项2期、随机、双盲、安慰剂对照、平行研究,旨在评估皮下注射BW-00112治疗重度高甘油三酯血症受试者的有效性和安全性
主要入选标准
1.知情同意时年龄为 18 岁至 75 岁(含)的男性或女性。
2.筛选时有 TG ≥ 500 mg/dL(5.6 mmol/L)且 ≤ 4000 mg/dL(45 mmol/L)的病史证据。
3.筛选时至少有两次检测空腹 TG ≥ 500mg/dL(5.6 mmol/L)。
4.接受稳定的调脂饮食,加药物(例如他汀类、烟酸、omega-3 脂肪酸)
治疗,调脂饮食和药物剂量应在筛选前稳定至少 4 周(贝特类 6 周,PCSK9 抑制剂 8 周)。
5.筛选时体质指数(BMI)为 18-40 kg/㎡(含)。
6.愿意在整个研究期间维持之前推荐的饮食和运动方案,遵守生活方式的要求。
7.愿意在整个研究期间,男性每周饮酒不超过 21 单位,女性每周饮酒不超过 14 单位。愿意在每次研究访视前 24 小时内避免饮酒。
8.女性须处于非妊娠期和非哺乳期,或是手术绝育或绝经后。有生育能力的女性如果她们在筛选前 28 天至最后一次给药后 24 周内使用高效避孕方法,则可以参加。
9.如果男性受试者的伴侣在筛选至最后一次给药后 24 周内可能妊娠,则男性受试者同意使用可接受的避孕方法。
排除标准
1.首次给药第 1 天前 12 周内发生急性胰腺炎。
2. 首次给药第 1 天前 24 周内发生急性心血管事件或手术或在研究期间计划接受这些手术。
3. 首次给药第 1 天前 12 周内接受过较大的手术、有重大外伤或在研究期间需要接受住院治疗的择期手术的受试者。
4. 受试者筛选时有未控制的高血压。
5. 筛选时心力衰竭纽约心功能分级(NYHA)为 2、3、4 级或已知的左室射血分数<30%。
6. 任何会影响血脂或脂蛋白的有临床意义的未控制性疾病。
7. 有肿瘤史或现病史,已治愈的皮肤基底细胞癌或鳞状细胞癌或子宫颈原位癌除外。
8. 任何研究者认为会导致受试者面临风险,干扰参与研究或干扰研究结果的医学或精神状况。
9. 首次给药第 1 天前 5 年内有酒精和/或药物滥用史。
10. 首次给药第 1 天前 6 个月内使用洛美他派或 4 周内接受血脂分离或血浆置换或计划在研究期间接受这些治疗。
11. 乙酰半乳糖胺(GalNAc)过敏反应史。
12. 首次给药第 1 天前 12 个月内使用寡核苷酸。
13. 首次给药第 1 天前 30 天或 5 个半衰期(以较长者为准)内参加过其他药物临床试验者。
14. 筛选时临床实验室检查异常。
15. 人类免疫缺陷病毒(HIV)感染、乙型肝炎病毒(HBV)血清阳性、丙型肝炎病毒(HCV)血清阳性或梅毒感染。
16. 筛选时任何有临床意义的 12 导联心电图发现使受试者参与研究面临风险或干扰。
17. 筛选前 30 天内献血或失血超过 200mL。
18. 研究者判断受试者不适合入组或干扰参与或完成研究的任何情况。
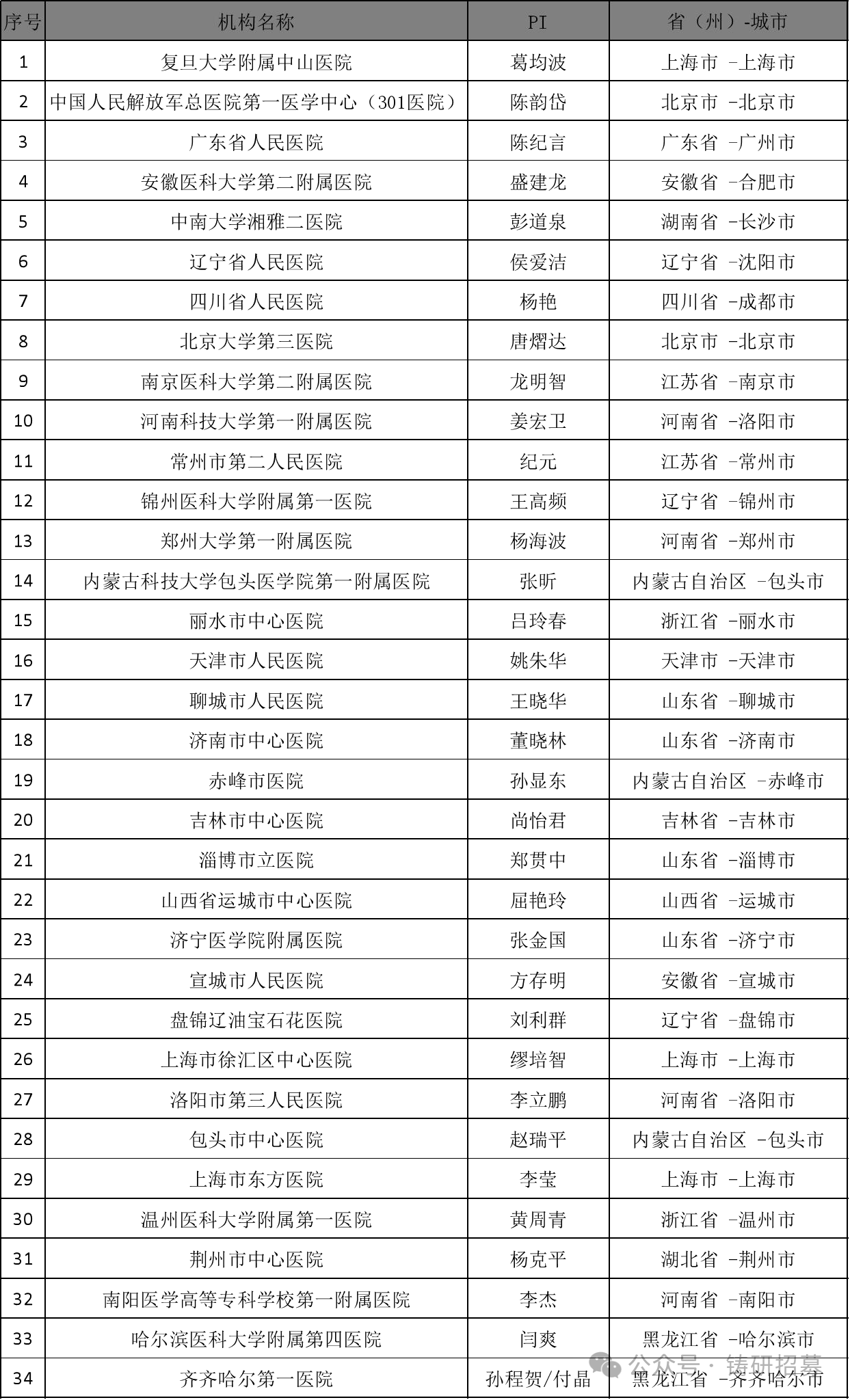
参与机构
试验信息
试验分期:II期
药品名称:BW-00112 注射液
适应症:重度高甘油三酯血症患者
患者画像:年龄不超过 75 周岁,TG (高油三脂)≥ 500 mg/dL(5.6 mmol/L)且≤ 4000 mg/dL(45 mmol/L)的重度高甘油三酯血症患者
注:边缘升高:甘油三酯水平在 1.7~2.3 mmol/L;升高:血清甘油三酯水平在 2.3~5.6 mmol/L;重度升高:血清甘油三酯水平大于 5.6 mmol/L。
试验专业题目
一项2期、随机、双盲、安慰剂对照、平行研究,旨在评估皮下注射BW-00112治疗重度高甘油三酯血症受试者的有效性和安全性
主要入选标准
1.知情同意时年龄为 18 岁至 75 岁(含)的男性或女性。
2.筛选时有 TG ≥ 500 mg/dL(5.6 mmol/L)且 ≤ 4000 mg/dL(45 mmol/L)的病史证据。
3.筛选时至少有两次检测空腹 TG ≥ 500mg/dL(5.6 mmol/L)。
4.接受稳定的调脂饮食,加药物(例如他汀类、烟酸、omega-3 脂肪酸)
治疗,调脂饮食和药物剂量应在筛选前稳定至少 4 周(贝特类 6 周,PCSK9 抑制剂 8 周)。
5.筛选时体质指数(BMI)为 18-40 kg/㎡(含)。
6.愿意在整个研究期间维持之前推荐的饮食和运动方案,遵守生活方式的要求。
7.愿意在整个研究期间,男性每周饮酒不超过 21 单位,女性每周饮酒不超过 14 单位。愿意在每次研究访视前 24 小时内避免饮酒。
8.女性须处于非妊娠期和非哺乳期,或是手术绝育或绝经后。有生育能力的女性如果她们在筛选前 28 天至最后一次给药后 24 周内使用高效避孕方法,则可以参加。
9.如果男性受试者的伴侣在筛选至最后一次给药后 24 周内可能妊娠,则男性受试者同意使用可接受的避孕方法。
排除标准
1.首次给药第 1 天前 12 周内发生急性胰腺炎。
2. 首次给药第 1 天前 24 周内发生急性心血管事件或手术或在研究期间计划接受这些手术。
3. 首次给药第 1 天前 12 周内接受过较大的手术、有重大外伤或在研究期间需要接受住院治疗的择期手术的受试者。
4. 受试者筛选时有未控制的高血压。
5. 筛选时心力衰竭纽约心功能分级(NYHA)为 2、3、4 级或已知的左室射血分数<30%。
6. 任何会影响血脂或脂蛋白的有临床意义的未控制性疾病。
7. 有肿瘤史或现病史,已治愈的皮肤基底细胞癌或鳞状细胞癌或子宫颈原位癌除外。
8. 任何研究者认为会导致受试者面临风险,干扰参与研究或干扰研究结果的医学或精神状况。
9. 首次给药第 1 天前 5 年内有酒精和/或药物滥用史。
10. 首次给药第 1 天前 6 个月内使用洛美他派或 4 周内接受血脂分离或血浆置换或计划在研究期间接受这些治疗。
11. 乙酰半乳糖胺(GalNAc)过敏反应史。
12. 首次给药第 1 天前 12 个月内使用寡核苷酸。
13. 首次给药第 1 天前 30 天或 5 个半衰期(以较长者为准)内参加过其他药物临床试验者。
14. 筛选时临床实验室检查异常。
15. 人类免疫缺陷病毒(HIV)感染、乙型肝炎病毒(HBV)血清阳性、丙型肝炎病毒(HCV)血清阳性或梅毒感染。
16. 筛选时任何有临床意义的 12 导联心电图发现使受试者参与研究面临风险或干扰。
17. 筛选前 30 天内献血或失血超过 200mL。
18. 研究者判断受试者不适合入组或干扰参与或完成研究的任何情况。
参与机构
