
试验信息
试验分期:II期
药品名称:PM8002
适应症:神经内分泌瘤
试验专业题目
评价PM8002注射液联合化疗二线治疗不可手术神经内分泌肿瘤受试者的初步疗效、安全性及药代动力学特征的II期临床试验
入选标准
1、自愿参加临床研究;完全了解本研究并自愿签署知情同意书;愿意遵循并有能力完成所有试验程序;
2、男性或女性,年龄≥ 18岁;
3、经本研究病理诊断确认为组织学或细胞学确诊的不能手术切除的局部晚期或转移性Ki-67 ≥ 55% G3 NET和NEC(包括混合性神经内分泌-非神经内分泌肿瘤[神经内分泌癌成分至少占30%及以上],不包括SCLC和Merkel细胞癌),病理诊断以2022 WHO神经内分泌肿瘤分类为标准;
4、既往接受过含铂方案一线化疗失败(包含进展和不耐受)的神经内分泌肿瘤患者;接受新辅助、辅助治疗的患者,治疗期间或末次治疗后6个月内疾病复发视为一线治疗失败;
5、明确有符合RECIST1.1要求的可测量病灶;如果既往接受过局部治疗(放疗、消融、血管介入等)的病灶是唯一病灶,则必须有该病灶疾病进展的明确影像学依据,不接受将仅有的骨转移病灶或仅有的中枢神经系统转移病灶作为可测量病灶;
6、有充足的器官功能(在开始研究药物治疗前14天内,未接受输血、促红细胞生成素、粒细胞集落刺激因子、白蛋白或其他医学支持的情况下),定义如下:
6.1)血液系统:
a)中性粒细胞计数(ANC)≥ 1.5×109/L;
b)血小板计数(PLT)≥ 100×109/L;
c)血红蛋白(Hb)≥ 90 g/L;
6.2)肝功能:
a)谷草转氨酶(AST)或谷丙转氨酶(ALT)水平≤3×ULN,肝转移受试者应≤5×ULN;
b)总胆红素(TBIL)≤1.5×正常上限(ULN),肝转移受试者应≤2×ULN
6.3)肾功能:
a)血清肌酐 ≤ 1.5 × ULN或肌酐清除率≥ 50 ml/min(Cockcroft-Gault公式:([140-年龄]×体重[kg]×[0.85,仅对于女性])/(72×肌酐(mg/dL)));(肌酐单位换算:1 mg/dL = 88.4 μmol/L);
b)尿蛋白定性≤1+;若尿蛋白定性≥2+,则需进行24 h尿蛋白定量检查,若24 h尿蛋白定量<1g,则可以接受;
6.4)凝血功能:
国际标准化比值(INR)、部分凝血活酶时间(APTT)、凝血酶原时间(PT)≤ 1.5 ×ULN;
7、美国东部肿瘤协作组(ECOG)体力状况(PS)评分为0~1;
8、预期生存期 ≥ 12周;
9、受试者应在筛选期提供(最长不超过24个月)经福尔马林固定-石蜡包埋(FFPE)处理的肿瘤样本:
9.1)未染色切片(3 ~5 μm)用于病理诊断;
9.2)未染色切片(3 ~5 μm)用于PD-L1表达水平回顾性分析;如不能提供病理诊断和/或供PD-L1回顾性分析的肿瘤组织标本,受试者应在筛选期进行新鲜肿瘤病灶活检(不接受骨活检、细针穿刺活检及胸腹水样本;也不接受对仅有唯一靶病灶可供活检的受试者进行活检),以获得足够的合格肿瘤组织标本用于病理诊断和/或生物标志物分析; 如受试者因特殊原因无法提供符合上述要求的标本,经与申办方沟通后决定受试者是否可以参与筛选。
10、有生育能力的女性受试者开始研究治疗前7天内的血妊娠结果为阴性,且愿意从签署知情同意书起至末次用药结束后6个月内,保持禁欲或采取经医学认可的高效避孕措施(如宫内节育器、避孕套);
11、男性受试者愿意从签署知情同意书起至末次用药结束后6个月内,禁欲或采取经医学认可的高效避孕措施,且在此期间不捐献精子。
排除标准
1、严重过敏性疾病史、药物(含未上市的试验药物)严重过敏史或已知对本研究药物任何成分过敏;
2、既往接受过任何抗程序性死亡受体1(PD-1)抗体、抗PD-L1抗体、抗PD-L2抗体或抗细胞毒T淋巴细胞相关抗原-4(CTLA-4)抗体或作用于T细胞协同刺激或检查点通路的任何其它抗体(如OX40、CD137等);3、既往接受过伊立替康治疗; 4、既往接受过抗血管内皮生长因子(VEGF)/血管内皮生长因子受体(VEGFR)或小分子TKI治疗; 5、已知UGT1A1 酶活性减低(比如UGT1A1*28或UGT1A1*6基因纯合型的患者); 6、伴随用药中有或者接受研究药物治疗前14天内使用过CYP3A4强诱导剂(苯妥英或卡马西平、巴比妥类药物、利福平、利福布汀或利福喷汀、贯叶连翘等);或CYP3A4强抑制剂(克拉霉素、酮康唑或伊曲康唑、茚地那韦、阿扎那韦、洛匹那韦、萘法唑酮、奈非那韦、利托那韦、沙奎那韦、特拉匹韦、伏立康唑等);或UGT1A1强抑制剂(阿扎那韦、吉非罗齐、茚地那韦等),或在研究期间以上药物不能暂停给药的患者;
7、具有临床症状的脑实质转移或脑膜转移,经研究者判断不适合入组;
8、具有重大出凝血障碍或其他明显出血风险证据:
(1)颅内出血或脊髓内出血病史;
(2)肿瘤病灶侵犯大血管且具有明显出血风险者;
(3)开始研究治疗前6个月内,发生过血栓形成或栓塞事件(无症状且无需治疗的肌间静脉血栓除外),或患有显著的血管疾病(如需手术修复的主动脉瘤);
(4)开始研究治疗前6个月内出现任何原因的临床显著的咯血或肿瘤出血;
(5)开始研究治疗前6个月内出现过食管和/或胃静脉曲张出血;
(6)开始研究治疗前2周内,使用出于治疗目的的抗凝治疗(低分子量肝素除外);
(7)开始研究治疗前10天内,使用抗血小板药物治疗,如阿司匹林(> 325 mg/天)、氯吡格雷(> 75 mg/天)、双嘧达莫、噻氯匹定或西洛他唑等,或需要长期抗血小板治疗者;
9、在开始研究药物治疗前接受过以下治疗或药物;
(1)开始研究药物治疗前4周内接受过重要脏器外科手术(不包括穿刺活检)或出现过显著外伤,或需要在试验期间接受择期手术;
(2)开始研究治疗前4周内接受过化疗、放疗、生物治疗、内分泌治疗等抗肿瘤治疗,或接受过任何其他未上市研究药物的治疗;以下情况也需排除:开始研究治疗前6周内接受过亚硝基脲或丝裂霉素C治疗;开始研究治疗前2周或药物的5个半衰期内(以时间长者为准)接受过口服氟尿嘧啶类和小分子靶向药物治疗;开始研究治疗前2周内接受过有抗肿瘤适应症的中药治疗;
(3)开始研究药物治疗前14天内接受过全身免疫刺激剂治疗(如胸腺肽、干扰素-α [IFN-α]、白介素-2 [IL-2])或仍处于治疗药物的5个半衰期内(取二者中较长者);
(4)开始研究药物治疗前14天内接受过全身使用的糖皮质激素(强的松 > 10 mg/天或等价剂量的同类药物)或其他免疫抑制剂治疗;除外以下情况:使用局部、眼部、关节腔内、鼻内和吸入型糖皮质激素治疗;短期使用糖皮质激素进行预防治疗(如预防奥沙利铂所致呕吐、造影剂过敏);
(5)开始研究药物治疗前4周内接种过减毒活疫苗;
10、既往接受过抗肿瘤治疗的受试者必须所有治疗相关毒性恢复至≤ 1级,且无需皮质醇激素治疗(研究者判断无安全风险的毒性除外,如脱发、2级外周神经毒性、经激素替代治疗稳定的甲状腺功能减退等);
11、患有慢性炎性肠病和/或肠梗阻;
12、患有活动性、或曾患过且有复发可能的自身免疫性疾病的受试者(如系统性红斑狼疮,类风湿性关节炎,血管炎等),除外临床稳定的自身免疫甲状腺病、I型糖尿病受试者;
13、开始研究药物治疗前6个月内,出现以下情况:
(1)急性冠脉综合征、冠状动脉旁路移植术、充血性心力衰竭、主动脉夹层、脑卒中或其他3级及以上心脑血管事件;
(2)经Fridericia法校正的QT间期(QTcF)均值,男性>450 ms,女性 > 470 ms;
(3)存在任何增加QTc延长风险或心律失常风险的因素,如心衰、低钾血症、先天性长QT综合症、或正在使用任何已知可延长QT间期的伴随药物;
(4)美国纽约心脏病协会(NYHA)心功能分级≥II级,或左室射血分数(LVEF)< 50%;
(5)使用心脏起搏器;
14、目前存在无法控制的胸腔、心包、腹腔积液;
15、目前存在需要静脉抗感染治疗的活动性感染者(如结核或者梅毒);或2周内接受过静脉抗感染治疗;
参与机构
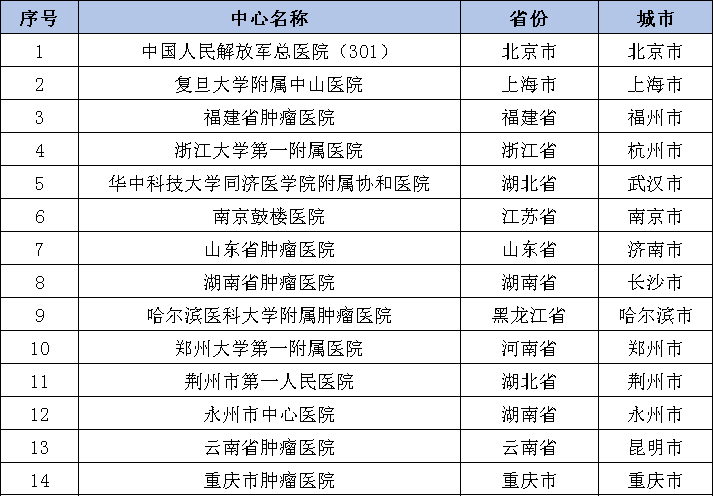
试验信息
试验分期:II期
药品名称:PM8002
适应症:神经内分泌瘤
试验专业题目
评价PM8002注射液联合化疗二线治疗不可手术神经内分泌肿瘤受试者的初步疗效、安全性及药代动力学特征的II期临床试验
入选标准
1、自愿参加临床研究;完全了解本研究并自愿签署知情同意书;愿意遵循并有能力完成所有试验程序;
2、男性或女性,年龄≥ 18岁;
3、经本研究病理诊断确认为组织学或细胞学确诊的不能手术切除的局部晚期或转移性Ki-67 ≥ 55% G3 NET和NEC(包括混合性神经内分泌-非神经内分泌肿瘤[神经内分泌癌成分至少占30%及以上],不包括SCLC和Merkel细胞癌),病理诊断以2022 WHO神经内分泌肿瘤分类为标准;
4、既往接受过含铂方案一线化疗失败(包含进展和不耐受)的神经内分泌肿瘤患者;接受新辅助、辅助治疗的患者,治疗期间或末次治疗后6个月内疾病复发视为一线治疗失败;
5、明确有符合RECIST1.1要求的可测量病灶;如果既往接受过局部治疗(放疗、消融、血管介入等)的病灶是唯一病灶,则必须有该病灶疾病进展的明确影像学依据,不接受将仅有的骨转移病灶或仅有的中枢神经系统转移病灶作为可测量病灶;
6、有充足的器官功能(在开始研究药物治疗前14天内,未接受输血、促红细胞生成素、粒细胞集落刺激因子、白蛋白或其他医学支持的情况下),定义如下:
6.1)血液系统:
a)中性粒细胞计数(ANC)≥ 1.5×109/L;
b)血小板计数(PLT)≥ 100×109/L;
c)血红蛋白(Hb)≥ 90 g/L;
6.2)肝功能:
a)谷草转氨酶(AST)或谷丙转氨酶(ALT)水平≤3×ULN,肝转移受试者应≤5×ULN;
b)总胆红素(TBIL)≤1.5×正常上限(ULN),肝转移受试者应≤2×ULN
6.3)肾功能:
a)血清肌酐 ≤ 1.5 × ULN或肌酐清除率≥ 50 ml/min(Cockcroft-Gault公式:([140-年龄]×体重[kg]×[0.85,仅对于女性])/(72×肌酐(mg/dL)));(肌酐单位换算:1 mg/dL = 88.4 μmol/L);
b)尿蛋白定性≤1+;若尿蛋白定性≥2+,则需进行24 h尿蛋白定量检查,若24 h尿蛋白定量<1g,则可以接受;
6.4)凝血功能:
国际标准化比值(INR)、部分凝血活酶时间(APTT)、凝血酶原时间(PT)≤ 1.5 ×ULN;
7、美国东部肿瘤协作组(ECOG)体力状况(PS)评分为0~1;
8、预期生存期 ≥ 12周;
9、受试者应在筛选期提供(最长不超过24个月)经福尔马林固定-石蜡包埋(FFPE)处理的肿瘤样本:
9.1)未染色切片(3 ~5 μm)用于病理诊断;
9.2)未染色切片(3 ~5 μm)用于PD-L1表达水平回顾性分析;如不能提供病理诊断和/或供PD-L1回顾性分析的肿瘤组织标本,受试者应在筛选期进行新鲜肿瘤病灶活检(不接受骨活检、细针穿刺活检及胸腹水样本;也不接受对仅有唯一靶病灶可供活检的受试者进行活检),以获得足够的合格肿瘤组织标本用于病理诊断和/或生物标志物分析; 如受试者因特殊原因无法提供符合上述要求的标本,经与申办方沟通后决定受试者是否可以参与筛选。
10、有生育能力的女性受试者开始研究治疗前7天内的血妊娠结果为阴性,且愿意从签署知情同意书起至末次用药结束后6个月内,保持禁欲或采取经医学认可的高效避孕措施(如宫内节育器、避孕套);
11、男性受试者愿意从签署知情同意书起至末次用药结束后6个月内,禁欲或采取经医学认可的高效避孕措施,且在此期间不捐献精子。
排除标准
1、严重过敏性疾病史、药物(含未上市的试验药物)严重过敏史或已知对本研究药物任何成分过敏;
2、既往接受过任何抗程序性死亡受体1(PD-1)抗体、抗PD-L1抗体、抗PD-L2抗体或抗细胞毒T淋巴细胞相关抗原-4(CTLA-4)抗体或作用于T细胞协同刺激或检查点通路的任何其它抗体(如OX40、CD137等);3、既往接受过伊立替康治疗; 4、既往接受过抗血管内皮生长因子(VEGF)/血管内皮生长因子受体(VEGFR)或小分子TKI治疗; 5、已知UGT1A1 酶活性减低(比如UGT1A1*28或UGT1A1*6基因纯合型的患者); 6、伴随用药中有或者接受研究药物治疗前14天内使用过CYP3A4强诱导剂(苯妥英或卡马西平、巴比妥类药物、利福平、利福布汀或利福喷汀、贯叶连翘等);或CYP3A4强抑制剂(克拉霉素、酮康唑或伊曲康唑、茚地那韦、阿扎那韦、洛匹那韦、萘法唑酮、奈非那韦、利托那韦、沙奎那韦、特拉匹韦、伏立康唑等);或UGT1A1强抑制剂(阿扎那韦、吉非罗齐、茚地那韦等),或在研究期间以上药物不能暂停给药的患者;
7、具有临床症状的脑实质转移或脑膜转移,经研究者判断不适合入组;
8、具有重大出凝血障碍或其他明显出血风险证据:
(1)颅内出血或脊髓内出血病史;
(2)肿瘤病灶侵犯大血管且具有明显出血风险者;
(3)开始研究治疗前6个月内,发生过血栓形成或栓塞事件(无症状且无需治疗的肌间静脉血栓除外),或患有显著的血管疾病(如需手术修复的主动脉瘤);
(4)开始研究治疗前6个月内出现任何原因的临床显著的咯血或肿瘤出血;
(5)开始研究治疗前6个月内出现过食管和/或胃静脉曲张出血;
(6)开始研究治疗前2周内,使用出于治疗目的的抗凝治疗(低分子量肝素除外);
(7)开始研究治疗前10天内,使用抗血小板药物治疗,如阿司匹林(> 325 mg/天)、氯吡格雷(> 75 mg/天)、双嘧达莫、噻氯匹定或西洛他唑等,或需要长期抗血小板治疗者;
9、在开始研究药物治疗前接受过以下治疗或药物;
(1)开始研究药物治疗前4周内接受过重要脏器外科手术(不包括穿刺活检)或出现过显著外伤,或需要在试验期间接受择期手术;
(2)开始研究治疗前4周内接受过化疗、放疗、生物治疗、内分泌治疗等抗肿瘤治疗,或接受过任何其他未上市研究药物的治疗;以下情况也需排除:开始研究治疗前6周内接受过亚硝基脲或丝裂霉素C治疗;开始研究治疗前2周或药物的5个半衰期内(以时间长者为准)接受过口服氟尿嘧啶类和小分子靶向药物治疗;开始研究治疗前2周内接受过有抗肿瘤适应症的中药治疗;
(3)开始研究药物治疗前14天内接受过全身免疫刺激剂治疗(如胸腺肽、干扰素-α [IFN-α]、白介素-2 [IL-2])或仍处于治疗药物的5个半衰期内(取二者中较长者);
(4)开始研究药物治疗前14天内接受过全身使用的糖皮质激素(强的松 > 10 mg/天或等价剂量的同类药物)或其他免疫抑制剂治疗;除外以下情况:使用局部、眼部、关节腔内、鼻内和吸入型糖皮质激素治疗;短期使用糖皮质激素进行预防治疗(如预防奥沙利铂所致呕吐、造影剂过敏);
(5)开始研究药物治疗前4周内接种过减毒活疫苗;
10、既往接受过抗肿瘤治疗的受试者必须所有治疗相关毒性恢复至≤ 1级,且无需皮质醇激素治疗(研究者判断无安全风险的毒性除外,如脱发、2级外周神经毒性、经激素替代治疗稳定的甲状腺功能减退等);
11、患有慢性炎性肠病和/或肠梗阻;
12、患有活动性、或曾患过且有复发可能的自身免疫性疾病的受试者(如系统性红斑狼疮,类风湿性关节炎,血管炎等),除外临床稳定的自身免疫甲状腺病、I型糖尿病受试者;
13、开始研究药物治疗前6个月内,出现以下情况:
(1)急性冠脉综合征、冠状动脉旁路移植术、充血性心力衰竭、主动脉夹层、脑卒中或其他3级及以上心脑血管事件;
(2)经Fridericia法校正的QT间期(QTcF)均值,男性>450 ms,女性 > 470 ms;
(3)存在任何增加QTc延长风险或心律失常风险的因素,如心衰、低钾血症、先天性长QT综合症、或正在使用任何已知可延长QT间期的伴随药物;
(4)美国纽约心脏病协会(NYHA)心功能分级≥II级,或左室射血分数(LVEF)< 50%;
(5)使用心脏起搏器;
14、目前存在无法控制的胸腔、心包、腹腔积液;
15、目前存在需要静脉抗感染治疗的活动性感染者(如结核或者梅毒);或2周内接受过静脉抗感染治疗;
参与机构
